Gruodžio 29 d. ankstyvą rytą NEJM internete paskelbė naują klinikinį III fazės naujojo Kinijos koronaviruso VV116 tyrimą. Rezultatai parodė, kad VV116 klinikinio pasveikimo trukmės požiūriu nebuvo blogesnė už Paxlovid (nematovirą/ritonavirą) ir sukėlė mažiau nepageidaujamų reiškinių.
Vaizdo šaltinis: NEJM
Vidutinis atsigavimo laikas – 4 dienos, nepageidaujamų reiškinių dažnis – 67,4 %.
VV116 yra geriamasis nukleozidinis vaistas nuo naujojo koronaviruso (SARS-CoV-2), sukurtas bendradarbiaujant su „Junsit“ ir Wang Shan Wang Shui. Jis yra RdRp inhibitorius, veikiantis kartu su „Gilead“ remdesiviru, „Merck Sharp & Dohme“ molnupiraviru ir „Real Biologics“ azelvudinu.
2021 m. Uzbekistane buvo baigtas II fazės VV116 klinikinis tyrimas. Tyrimo rezultatai parodė, kad VV116 grupė, palyginti su kontroline grupe, galėjo geriau pagerinti klinikinius simptomus ir reikšmingai sumažinti ligos progresavimo iki kritinės formos bei mirties riziką. Remiantis teigiamais šio tyrimo rezultatais, VV116 buvo patvirtintas Uzbekistane vidutinio sunkumo ir sunkios COVID-19 ligos gydymui ir tapo pirmuoju nauju geriamuoju koronarinės širdies ligos vaistu, patvirtintu rinkai užsienyje, Kinijoje [1].
Šis III fazės klinikinis tyrimas[2] (NCT05341609), kuriam vadovavo Šanchajaus Ruijin ligoninės prof. Zhao Ren, Šanchajaus Renji ligoninės prof. Gaoyuan ir Šanchajaus Ruijin ligoninės akademikas Ning Guang, buvo atliktas Omicron varianto (B.1.1.529) sukelto protrūkio metu nuo kovo iki gegužės Šanchajuje, siekiant įvertinti VV116 ir Paxlovid veiksmingumą ir saugumą ankstyvam lengvo ar vidutinio sunkumo COVID-19 gydymui. Tyrimo tikslas buvo įvertinti VV116 ir Paxlovid veiksmingumą ir saugumą ankstyvam lengvo ar vidutinio sunkumo COVID-19 gydymui.
Vaizdo šaltinis: 2 nuoroda
2022 m. balandžio 4 d. – gegužės 2 d. buvo atliktas daugiacentris, stebėtojui aklas, atsitiktinių imčių kontroliuojamas tyrimas, kuriame dalyvavo 822 suaugę Covid-19 pacientai, kuriems buvo didelė progresavimo rizika ir lengvi arba vidutinio sunkumo simptomai. Tyrimo tikslas buvo įvertinti dalyvių iš septynių Šanchajaus (Kinija) ligoninių tinkamumą. Galiausiai 771 dalyvis gavo geriamąjį vaistą VV116 (384, po 600 mg kas 12 valandų 1 dieną ir po 300 mg kas 12 valandų 2–5 dienomis) arba Paxovid (387, po 300 mg nimatuviro + 100 mg ritonaviro kas 12 valandų 5 dienas).
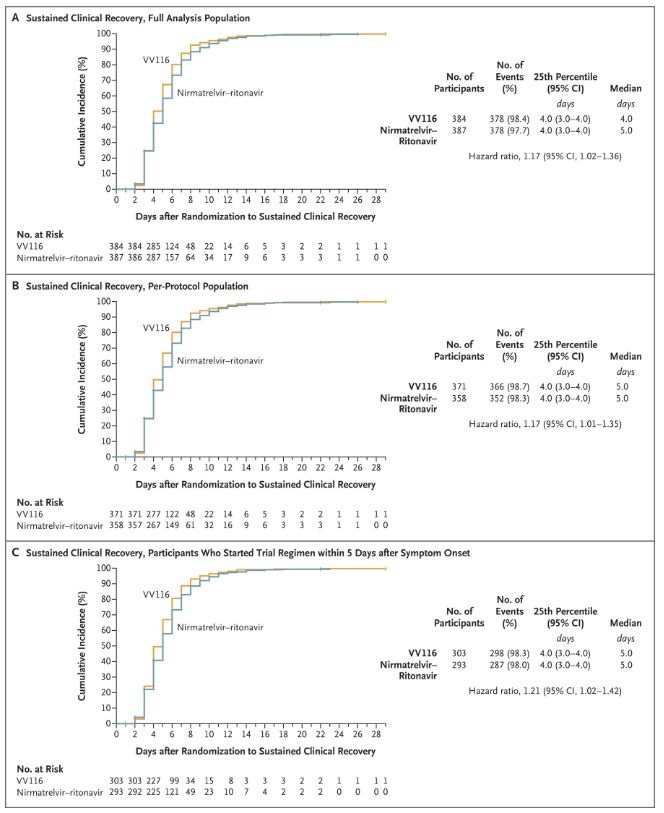
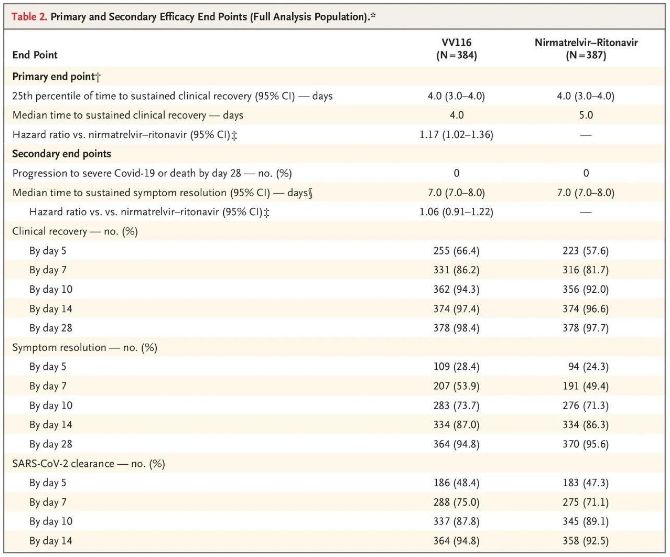
Šio klinikinio tyrimo rezultatai parodė, kad ankstyvas lengvo ar vidutinio sunkumo COVID-19 gydymas VV116 atitiko pirminį klinikinio protokolo numatytą vertinamąjį tašką (laiką iki ilgalaikio klinikinio pasveikimo): vidutinis laikas iki klinikinio pasveikimo buvo 4 dienos VV116 grupėje ir 5 dienos Paxlovid grupėje (pavojaus santykis – 1,17; 95 % PI – 1,02–1,36; apatinė riba >0,8).
Klinikinio atsigavimo laiko palaikymas
Pirminiai ir antriniai veiksmingumo vertinamieji rodikliai (išsami populiacijos analizė)
Vaizdo šaltinis: 2 nuoroda
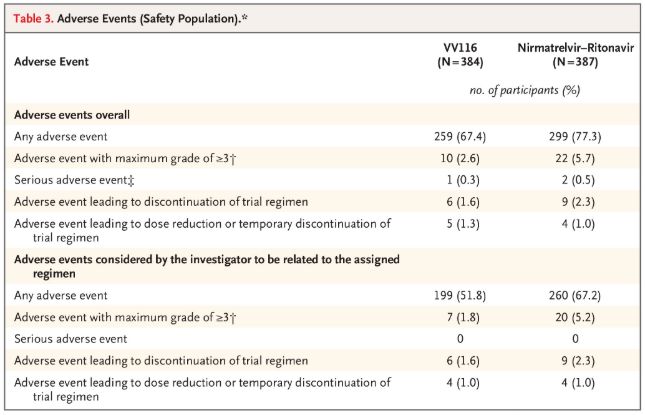
Kalbant apie saugumą, VV116 vartoję dalyviai per 28 dienų stebėjimo laikotarpį pranešė apie mažiau nepageidaujamų reiškinių (67,4 %) nei Paxlovid vartoję dalyviai (77,3 %), o 3/4 laipsnio nepageidaujamų reiškinių dažnis VV116 vartojusiųjų grupėje buvo mažesnis (2,6 %) nei Paxlovid vartojusiųjų grupėje (5,7 %).
Nepageidaujami reiškiniai (saugūs žmonės)
Vaizdo šaltinis: 2 nuoroda
Ginčai ir klausimai
2022 m. gegužės 23 d. „Juniper“ atskleidė, kad III fazės registracijos klinikinis tyrimas, kurio metu VV116 buvo lyginamas su PAXLOVID ankstyvam lengvo ar vidutinio sunkumo COVID-19 gydymui (NCT05341609), pasiekė pagrindinį tyrimo tikslą.
Vaizdo šaltinis: 1 nuoroda
Tuo metu, kai trūko išsamios informacijos apie tyrimą, III fazės tyrimą teminę kontroversiją sukėlė dvejopos priežastys: pirma, tai buvo viengubai aklas tyrimas, ir, nesant placebo kontrolės, buvo baiminamasi, kad bus sunku visiškai objektyviai įvertinti vaistą; antra, kilo klausimų dėl klinikinių vertinamųjų baigčių.
Klinikiniai įtraukimo į „Juniper“ tyrimą kriterijai yra šie: (i) teigiami naujojo koronarinės infekcijos testo rezultatai, (ii) vienas ar keli lengvi arba vidutinio sunkumo COVID-19 simptomai ir (iii) pacientai, kuriems yra didelė sunkios COVID-19 formos, įskaitant mirtį, rizika. Tačiau vienintelė pirminė klinikinė vertinamoji baigtis yra „laikas iki ilgalaikio klinikinio pasveikimo“.
Prieš pat pranešimą, gegužės 14 d., Juniper peržiūrėjo klinikinius vertinamuosius kriterijus, pašalindama vieną iš pagrindinių klinikinių vertinamųjų baigčių – „sunkios ligos ar mirties atvejų dalį“ [3].
Vaizdo šaltinis: 1 nuoroda
Šie du pagrindiniai ginčytini klausimai taip pat buvo konkrečiai aptarti paskelbtame tyrime.
Dėl staigaus „Omicron“ protrūkio „Paxlovid“ placebo tablečių gamyba nebuvo baigta iki tyrimo pradžios, todėl tyrėjai negalėjo atlikti šio tyrimo dvigubai aklu, dvigubai demonstraciniu dizainu. Kalbėdamas apie viengubai aklą klinikinio tyrimo aspektą, Juniper teigė, kad protokolas buvo parengtas pasikalbėjus su reguliavimo institucijomis ir kad viengubai aklas dizainas reiškia, kad nei tyrėjas (įskaitant tyrimo vertinamąjį tašką vertinantį asmenį), nei rėmėjas nežinos konkretaus terapinio vaisto paskirstymo, kol tyrimo pabaigoje nebus užrakinta galutinė duomenų bazė.
Iki galutinės analizės atlikimo nė vienas tyrimo dalyvis nemirė ir nepatyrė sunkios Covid-19 ligos eigos, todėl negalima daryti išvadų apie VV116 veiksmingumą užkertant kelią ligos progresavimui iki sunkios ar kritinės Covid-19 ligos eigos ar mirties. Duomenys rodo, kad apskaičiuota vidutinė trukmė nuo atsitiktinės atrankos iki ilgalaikės su Covid-19 susijusių tikslinių simptomų regresijos abiejose grupėse buvo 7 dienos (95 % PI, 7–8) (pavojaus santykis, 1,06; 95 % PI, 0,91–1,22) [2]. Nesunku paaiškinti, kodėl buvo pašalintas pagrindinis vertinamasis rodiklis „konversijos į sunkią ligą ar mirtį dažnis“, kuris iš pradžių buvo nustatytas prieš tyrimo pabaigą.
2022 m. gegužės 18 d. žurnalas „Emerging Microbes & Infections“ paskelbė pirmojo VV116 klinikinio tyrimo su pacientais, užsikrėtusiais Omicron variantu [4], rezultatus. Tai buvo atviras, perspektyvus kohortos tyrimas su 136 patvirtintais stacionariniais pacientais.
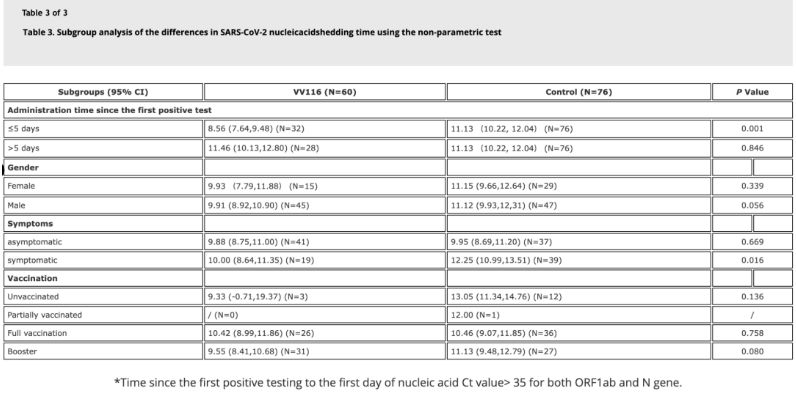
Tyrimo duomenys parodė, kad pacientams, sergantiems Omicron infekcija, kurie VV116 pavartojo per 5 dienas nuo pirmojo teigiamo nukleorūgščių testo, nukleorūgščių regresijos laikas buvo 8,56 dienos, t. y. trumpesnis nei 11,13 dienos kontrolinėje grupėje. VV116 skyrimas simptominiams pacientams per šio tyrimo laikotarpį (2–10 dienų nuo pirmojo teigiamo nukleorūgščių testo) sutrumpino nukleorūgščių regresijos laiką visiems pacientams. Kalbant apie vaisto saugumą, VV116 gydymo grupėje nebuvo pastebėta jokių rimtų nepageidaujamų reiškinių.
Vaizdo šaltinis: 4 nuoroda
Šiuo metu vyksta trys VV116 klinikiniai tyrimai, du iš jų yra III fazės lengvo ir vidutinio sunkumo COVID-19 tyrimai (NCT05242042, NCT05582629). Kitas vidutinio sunkumo ir sunkaus COVID-19 ligos tyrimas yra tarptautinis daugiacentris, atsitiktinių imčių, dvigubai aklas III fazės klinikinis tyrimas (NCT05279235), skirtas VV116 veiksmingumui ir saugumui, palyginti su standartiniu gydymu, įvertinti. Remiantis „Juniper“ pranešimu, pirmasis pacientas buvo įtrauktas į tyrimą ir jam buvo skirta dozė 2022 m. kovo mėn.
Vaizdo šaltinis: clinicaltrials.gov
Nuorodos:
[1] „Junshi Biotech“: Pranešimas apie pagrindinį III fazės registruoto klinikinio VV116 ir PAXLOVID tyrimo, skirto ankstyvam lengvo ar vidutinio sunkumo COVID-19 gydymui, vertinamąjį tašką.
2 Xu, Hao Yin, Zhiren Fu, Hao Xing, Li Li, Liying Sun, Heyu Huang, Quanbao Zhang, Linlin Xu, Yanting Jin, Rui Chen, Guoyue Lv, Zhijun Zhu, Wenhong Zhang, Zhengxin Wang. (2022) Omicron infekcijų profilis ir vakcinacijos būklė tarp 1881 kepenų transplantacijos recipiento: kelių centrų retrospektyvinė kohorta. Emerging Microbes & Infections 11:1, psl. 2636-2644.
Įrašo laikas: 2023 m. sausio 6 d.
 中文网站
中文网站